医疗器械行业的快速发展和技术的不断发展创新,需要法律制度的配合完善以及深化相关从业者对法律法规的理解。目前针对医疗器械行业的律师解读内容较多关注合规性文件及监管制度,从医疗器械注册人、备案人视角对上市后医疗器械产品导致患者损害的责任、患者权益保障和损害赔偿等问题的专业解读较少,导致众多创新医疗器械企业和相关从业者倍感困惑。为了进一步就此问题进行解析,基于在医疗健康行业多年的法律实务经验,在下文中对医疗器械上市后的产品责任进行较为全面的分析。
引言
2021年3月18日,最新修订的《医疗器械监督管理条例》正式发布,该条例于2020年12月21日国务院第119次常务会议修订通过,并将自2021年6月1日起施行。《医疗器械监督管理条例》是我国医疗器械监督管理的“基本法”,本次修订总结了以往的宝贵经验,从支持创新、简化流程、全生命周期医疗器械监管等方面进行改革,严厉打击医疗器械违法行为,符合国内医疗器械产业的发展趋势,充分保障大众用械安全有效,服务促进高质量发展。
此外,国家药品监督管理局于2021年3月26日发布了四部修订草案征求意见稿,即:《医疗器械经营监督管理办法(修订草案征求意见稿)》、《医疗器械生产监督管理办法(修订草案征求意见稿)》、《体外诊断试剂注册管理办法(修订草案征求意见稿)》和国家药品监督管理局关于《医疗器械注册管理办法(修订草案征求意见稿)》,旨在进一步完善医疗器械行业相关法律法规,进而促进行业健康发展。
根据北京普华有策信息咨询有限公司《2020-2026年全球及中国医疗器械行业全景调研与前景预测报告》[1],如今医疗器械行业已成为全球经济中发展最快、贸易往来最活跃、人均产值与行业利润率都居前列的行业之一。美国、欧洲、日本等发达国家和地区的医疗器械产业共占据全球医疗器械市场超八成的份额,其中,美国是全球最大的医疗器械生产国和消费国,消费量占全球的40%以上。以中国为首的亚洲、拉丁美洲等发展中国家,虽然起步较晚,但医疗电子设备市场发展较快,设备普及和升级换代的需求同时大量存在,常规医疗电子设备普及率快速提升,高端医疗电子设备产品市场需求量也保持快速增长。尤其是近些年,中国致力于完善医疗器械行业的相关法律法规,旨在引导和规范我国医疗器械行业的发展,事实上也的确起到了积极的推动作用,我国医疗器械行业进步明显,这一点可以从医疗器械注册情况变化中窥见一隅。
我国医疗器械注册情况
国家药品监督管理局于2021年2月5日发布《2020年度医疗器械注册工作报告》[2],其中指出,随着深化医疗器械审评审批制度改革,持续强化医疗器械注册管理,鼓励医疗器械产业创新发展,2020年国家药品监督管理局共批准医疗器械首次注册、延续注册和变更注册9849项,与2019年相比注册批准总数量增长16.3%。
报告同时公布了近7年国家药监局批准医疗器械注册情况,自《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)和中共中央办公厅国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)文件发布,2018年8月1日新版《医疗器械分类目录》的实施,以及配套医疗器械注册审批制度的修订完善,我国医疗器械注册批准数量从2018年开始持续稳健增长。
2014年至2020年度医疗器械注册数据
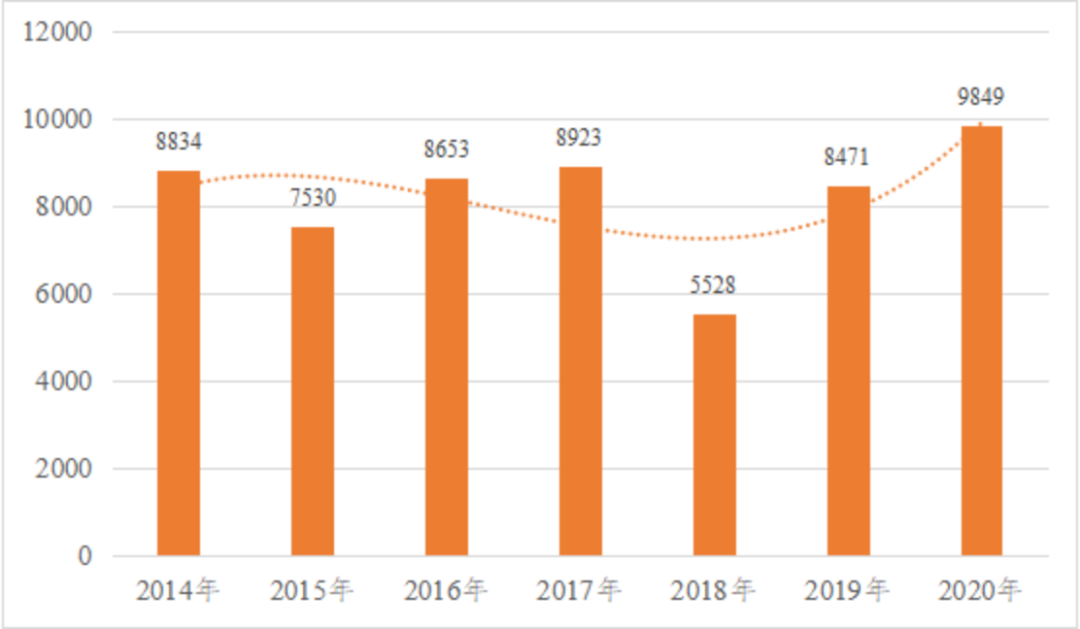
图片来源:《2020年度医疗器械注册工作报告》
其中,2020年国家药品监督管理局按照《创新医疗器械特别审查程序》和《医疗器械优先审批程序》持续推进创新战略,共收到创新医疗器械特别审批申请197项,54项获准进入特别审查程序;收到优先申请22项,12项获准优先审批。国家药品监督管理局在2020年共批准26个创新医疗器械产品上市,从2014年至2020年共批准99个创新医疗器械,这些医疗器械的上市可以进一步满足大众对高水平医疗器械的需要。
我国医疗器械不良事件情况
医疗器械作为一种强监管产品,其整个生命周期包括了研发、生产、审批、运输、储存、销售、使用等一系列过程,各个环节都要科学管理,否则有可能引发医疗损害或医疗事故,危及患者身体健康与生命安全。
在我国医疗器械注册批准数量持续增长、创新医疗器械产品快速涌现的背景下,为了科学监管与进一步保障患者安全,对于上市后医疗器械可能导致的患者损害,我国将不良事件监测作为管理的重要一环。为此,我国制定和修改了相关法律法规,其中最具影响力的是《医疗器械不良事件监测和再评价管理办法》(以下简称《办法》),该办法于2019年1月1日起施行,以评价医疗器械风险为主线,重点落实医疗器械注册人和备案人不良事件监测的主体责任。
《办法》中明确指出,医疗器械不良事件是指已上市的医疗器械,在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件。医疗器械不良事件的报告遵循“可疑即上报”的原则,即只要怀疑某事件为医疗器械不良事件,就可以报告。
为全面反映我国医疗器械不良事件监测情况,国家药品不良反应监测中心编撰了《国家医疗器械不良事件监测年度报告(2020年)》[3](以下简称《报告》),《报告》指出,2020年国家医疗器械不良事件监测信息系统共收到可疑医疗器械不良事件报告536,055份,比上年增加35.25%。
同时,《报告》对2016年至2020年间的可疑医疗器械不良事件进行统计,列于下图:
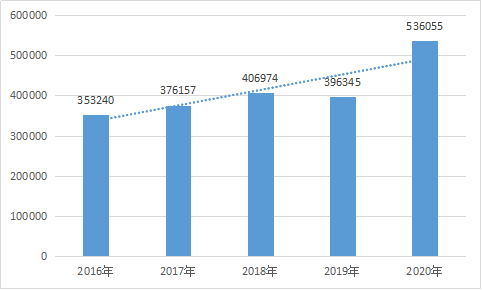
近5年全国可疑医疗器械不良事件报告数量
《国家医疗器械不良事件监测年度报告(2020年)》
近年来,我国不断推进医疗器械不良事件监测的覆盖度,以期能够得到更准确全面的数据。截止到2020年全国有28个省(自治区、直辖市)的医疗器械不良事件报告县级覆盖率达到100%,医疗器械不良事件监测系统基层注册用户数量持续提升,达到35万余家,其中医疗器械注册人达27,195家,因此可疑医疗器械不良事件的增长也有极大可能与报告收集工作的推进和系统用户的扩大存在一定程度的正相关关系。
2020年监测信息系统收到的可疑医疗器械不良事件报告涉及了医疗器械分类目录中的所有类别。报告数量排名前五位的医疗器械类别为:注输、护理和防护器械(报告数:226536;比例:42.26%),医用诊察和监护器械(报告数:53229;比例:9.93%),物理治疗器械(报告数:40731;比例:7.60%),临床检验器械(报告数:26002;比例:4.85%),呼吸、麻醉和急救器械(报告数:22036;比例:4.11%)。对于医疗器械不良事件伤害程度情况,《报告》也进行了统计分析。结果指出,2020年国家医疗器械不良事件监测信息系统收到的可疑医疗器械不良事件报告中,事件伤害程度为死亡的报告218份,占报告总数的0.04%;事件伤害程度为严重伤害的报告32874份,占报告总数的6.13%;事件伤害程度为其他的报告502963份,占报告总数的93.83%。
同时《报告》强调,目前遵循“可疑即上报”原则,但是实际上各类损害程度报告的数量会受到医疗器械风险程度、使用数量、临床使用情况、患者疾病进展和报告人认知等多种因素影响,因此,统计报告中事件伤害程度为死亡或者严重伤害的医疗器械不良事件报告数量不直接代表医疗器械的安全性评价结论。
同时,为充分保障患者安全、明确对患者伤害严重的不良事件因果关系,2020年国家药品不良反应监测中心对于事件伤害程度为死亡的可疑医疗器械不良事件报告,均及时进行了处置,督促注册人、备案人开展调查、评价。在目前完成分析评价的事件中,绝大多数与涉及医疗器械无明确相关性,这也进一步佐证了相关医疗器械的安全性,增强了行业发展的信心。
但是,对于一些医疗器械产品存在缺陷,与患者损害有明显因果关系的案件,需要医疗器械注册人、备案人承担相应的产品责任,下文将结合法律法规和具体案例进行详细阐述。
医疗器械产品责任纠纷案件的法律规定
为了充分保障使用医疗器械的患者安全,我国从法律层面对医疗器械产品责任进行规定,主要集中在《中华人民共和国民法典》侵权编第四章产品责任和第六章医疗损害责任。
其中第四章产品责任的规定属于产品责任的一般性条款。针对药品、医疗器械或不合格血液等特殊医疗产品,在医疗损害责任这一章中又进行了特别规定。同时,在2020年最高人民法院最新修订的《最高人民法院关于审理医疗损害责任纠纷案件适用法律若干问题的解释(2020修订)》(以下简称《司法解释》)中,对于缺陷医疗产品责任纠纷的受理、举证责任分担和侵权责任分配都做出了明确规定。
对于一般产品责任,依据《民法典》第1203和1204条的规定,对生产者适用无过错责任原则,对销售者和运输者、仓储者等第三人适用过错责任原则。除此之外,我国还规定了产品责任的惩罚性赔偿适用范围。根据《民法典》第1207条,明知产品存在缺陷仍然生产、销售,或者没有根据1206条规定采取有效补救措施,造成他人死亡或者健康严重损害的,被侵权人有权请求相应的惩罚性赔偿。
相对于其他产品,药品、医疗器械等医疗产品存在着较高的风险,其产品来源和使用场所也较为固定和特殊。因此,我国《民法典》在医疗损害责任这一章中,进一步明确了医疗产品责任的承担主体。根据依据《民法典》第1223条规定,药品上市许可持有人、生产者、血液提供机构根据无过错责任原则承担责任。患者也可以向医疗机构请求赔偿,医疗机构赔偿后,有权向负有责任的药品上市许可持有人、生产者、血液提供机构追偿。如果是由于医疗机构或第三人过错导致医疗产品存在缺陷或不合格,医疗机构或第三人承担过错责任。除此之外,如果医疗机构诊疗过错和医疗产品缺陷同时存在,也即存在“多因一果”的情形,医疗机构与医疗产品的生产者、销售者、药品上市许可持有人承担连带责任。医疗机构或者医疗产品的生产者、销售者、药品上市许可持有人承担赔偿责任后,向其他责任主体追偿的,应当根据诊疗行为与缺陷医疗产品造成患者损害的原因力大小确定相应的赔偿责任。
如果医疗产品的生产者、销售者、药品上市许可持有人明知医疗产品存在缺陷仍然生产、销售,造成患者死亡或者健康严重损害,依据《司法解释》第23条的规定,对生产者、销售者、药品上市许可持有人适用二倍以下惩罚性赔偿。
另外,在《司法解释》第7条中对医疗产品责任的举证责任分担进行了明确规定。其中,患者应当提交使用医疗产品或者输入血液、受到损害的证据。如果患者无法提交使用医疗产品与损害之间具有因果关系的证据,可以依法申请鉴定,人民法院应予准许。即患者至少应完成药品存在缺陷、缺陷药品和原告的损害之间存在因果关系的证明责任。医疗机构,医疗产品的生产者、销售者、药品上市许可持有人或者血液提供机构主张不承担责任的,应当对医疗产品不存在缺陷或者血液合格等抗辩事由承担举证证明责任。
参考文献:
[1] 北京普华有策信息咨询有限公司《2020-2026年全球及中国医疗器械行业全景调研与前景预测报告》
[2] 国家药品监督管理局《2020年度医疗器械注册工作报告》
[3] 国家药品不良反应监测中心《国家医疗器械不良事件监测年度报告(2020年)》
重点领域
重大缺陷产品侵权致害案件 重大机动车交通事故责任纠纷 医疗机构诊疗致人损害案件 重大知识产权侵权纠纷 重大民事侵权纠纷案件代理重大疑难案件办理
重大疑难税务案件研讨 未登记建筑合法性论证 重大疑难刑事案件研讨 重大疑难行政案件论证 重大疑难民商诉讼案件代理范围
案件委托 出具法律意见书 法学专家论证 专家证人出庭 司法鉴定评估关于我们
联系我们 关于我们 资深律师 智律网 屋连网QQ/微信号
1056606199
